CORROSION
Corrosión es un ataque de un metal por reacción en su medio ambiente.
Corrosión, desgaste total o parcial que disuelve o ablanda cualquier sustancia por reacción química o electroquímica .
El término corrosión se aplica a la acción gradual de agentes naturales, como el aire o el agua salada sobre los metales.
El tema tiene gran interés practico ya que se ha comprobado en numerosos países que los perjuicios ocasionados por la corrosión representan el 1.5% y 3.5% del producto bruto nacional, sin recurrir a medios muy agresivos si no considerando solamente la atmósfera se encuentra que la mayoría de los metales en contacto con el medio ambiente forman un sistema termodinamicamente inestable con la única excepción de unos pocos metales llamados nobles(oro, platino,etc) todos los demás metales en contacto con el aire deberian reaccionar rápidamente y transformándose en óxidos
El ejemplo más familiar de corrosión es la oxidación del hierro, que consiste en una compleja reacción química en la que el hierro se combina con oxígeno y agua para formar óxido de hierro hidratado. El óxido es un sólido que mantiene la misma forma general que el metal del que se ha formado, pero con un aspecto poroso, algo más voluminoso, y relativamente débil y quebradizo.
Se considera la apariencia del metal con corrosión.
En general basta inspección visual para distinguir entre las formas de corrosión
siguientes:
La reacción actúa sobre toda la superficie expuesta (o sobre
un área grande).
El espesor del metal se reduce y eventualmente falla. Representa la mayor destrucción
de metal. La vida de un equipo o estructura puede estimarse mediante ensayos.
Se previene con protección catódica.
Las otras formas de corrosión son localizadas, y la zona afectada se reduce a partes de
la estructura.
Tienden a causar fallas prematuras o inesperadas.
Son más difíciles de calcular.
Dos metales diferentes generalmente tienen
diferencias de potencial cuando se los coloca en una solución conductiva. Si se ponen
en contacto los metales, entonces hay flujo de electrones entre ellos.
El metal menos resistente a corrosión pasa a ser ánodo, el más resistente pasa a ser
cátodo. El cátodo se corroe muy poco en este caso, pero el ánodo aumenta su
corrosión, comparado con los metales aislados entre sí.
Este principio puede usarse como forma de protección de una estructura. La estructura
se usa como cátodo. Como ánodo se usa Zn o magnesio (Mg), que no son resistentes a
corrosión. El ánodo se sacrifica.
En aberturas pequeñas (pueden ser hendiduras, grietas) se acumulan pequeñas
cantidades de solución estancada. Se deposita una sustancia (arena, polvo, corrosivo)
que actúa como escudo y crea las condiciones de ambiente estancado por debajo de
él. Se puede cortar el acero inoxidable colocándole una banda de goma alrededor y
sumergiéndolo en agua de mar. El efecto es formar una celda donde se concentra la
corrosión.
metal. Pueden hacer agujeros aislados o tan cercanos que dan la impresión visual de
una superficie rugosa.
Es una de las formas más destructivas, pero la perdida de material es muy poca. Es
difícil medirlo porque la perforación queda cubierta con el óxido. A veces requieren
tiempos largos para actuar (meses o años). Generalmente crece en la dirección de la
gravedad.
pero bajo ciertas condiciones, las interfases de granos son muy reactivas y se produce
corrosión localizada, sin que aparezca corrosión en los granos. Los granos se reparan, la aleación se desintegra o pierde rigidez. Puede ser causada por impureza en la aleación se desintegra o pierde rigidez. Puede ser causada por impureza en los
contornos de los granos. Es muy severa en soldaduras de acero inoxidable que ha sido
calentado 500 a 800C.
Ocurre por el movimiento relativo entre un fluido corrosivo y la superficie de un
metal. En general este movimiento es bastante rápido y ocurren desgastes mecánicos
o abrasión. El proceso remueve metal de la superficie como iones disueltos o forma
productos sólidos de corrosión que son barridos mecánicamente de la superficie
metálica. Aparecen ranuras, ondulaciones, agujeros redondeados, pero con un patrón
direccional dado por el movimiento del fluido. Las fallas ocurren en tiempos cortos
(semanas) y son inesperadas porque los ensayos de laboratorios se hacen en
condiciones estáticas que no reflejan las condiciones de erosión del flujo.
Es la fisuración producida por corrosión bajo tensión de tracción. Cuando hay fisuras
por corrosión bajo tensión (SCC) el resto de la superficie no aparece afectada y
aparecen fisuras finas que van creciendo. Las tensiones necesarias para falla por SCC
son del orden de las de diseño. La apariencia de las fisuras es como si fuera fractura
frágil, pueden ser entre granos o ir por dentro de granos.
Para diferentes tipos de acero el comportamiento es similar: al aumentar σ disminuye
el tR. ¿Hay un σmin necesario para que exista un tR? Puede ser del orden del 10% σy.
La fuente de σ puede ser cargas externas, tensiones residuales, térmicas, de soldadura.
Inicialmente la tasa de progreso de una fisura es constante, hasta que la sección
transversal se reduce y aumenta σ, hasta que se produce la rotura como un proceso
mecánico.
El tiempo es importante en SCC, debido a que la mayor parte del daño mecánico
ocurre para tiempos avanzados.
Las deformaciones ε no aumentan significativamente durante el proceso de fisuración,
pero llega un tiempo de exposición al agente corrosivo en el que suben (similar a una
fisuración) y se rompe el material.
Esto muestra que los ensayos de SCC deben hacerse hasta la rotura, porque los
fenómenos importantes ocurren sólo en las etapas finales.
Los mecanismos de SCC no se conocen muy bien, debido a la complejidad del
acoplamiento del metal, la interfase y el ambiente. La información más confiable es la
empírica. La corrosión juega un papel muy importante en el inicio de una fisura. Esto
produce concentración de σ, que aumenta a medida que el radio del agujero o ranura
disminuye. Puede producirse deformación plástica en el extremo de fisuras. Corrosión con fatiga
Es otro caso de corrosión bajo σ, aunque ocurre cuando hay ciclos de σ en el tiempo.
Se observa en la zona de fatiga la aparición de productos de corrosión, en lugar de ser
una zona casi suave como en fatiga sola.
La fatiga con corrosión es la reducción de la resistencia a fatiga debido a la presencia
de un medio corrosivo. La presencia de óxido en la superficie no garantiza que la falla
sea debida a la fatiga con corrosión, puede ser fatiga simple.
Es importante en industria aeroespacial, nuclear, off-shore, submarinos.
Incide en la frecuencia de ciclos de σ, siendo más pronunciada cuando las frecuencias
son bajas, lo que da más tiempo a que actúe la corrosión, dando mayor tiempo de
contacto con el agente corrosivo.
Se cree que la resistencia a fatiga ase reduce por el agente corrosivo porque los
pequeños agujeros de corrosión producen concentración de tensiones. La falla trans –
granular (por dentro de granos) y no se muestran las ramificaciones que son
características de fisuras que progresan entre bordes de granos del material.
Las etapas finales de fatiga con corrosión son iguales a las de fatiga porque ese
proceso es mecánico y no incide el agente corrosivo.
En la mecánica de fractura se suele cambiar KIC por otro valor KIC
SCC
que tome en
cuenta que la corrosión reduce la resistencia del material.
Por debajo de KIC
SCC
no ocurre fisuración por corrosión y deja de importar. Este
enfoque también se usa en fatiga con corrosión. Funciona bien en aceros con
aleaciones bajas y de alta resistencia. Es menos efectivo en aceros inoxidables
auteríticos.
FORMAS DE CORROSIÓN
En general basta inspección visual para distinguir entre las formas de corrosión
siguientes:
Corrosión uniforme:
La reacción actúa sobre toda la superficie expuesta (o sobre
un área grande).
El espesor del metal se reduce y eventualmente falla. Representa la mayor destrucción
de metal. La vida de un equipo o estructura puede estimarse mediante ensayos.
Se previene con protección catódica.
Las otras formas de corrosión son localizadas, y la zona afectada se reduce a partes de
la estructura.
Tienden a causar fallas prematuras o inesperadas.
Son más difíciles de calcular.
Corrosión galvánica o bimetálica:
Dos metales diferentes generalmente tienen
diferencias de potencial cuando se los coloca en una solución conductiva. Si se ponen
en contacto los metales, entonces hay flujo de electrones entre ellos.
El metal menos resistente a corrosión pasa a ser ánodo, el más resistente pasa a ser
cátodo. El cátodo se corroe muy poco en este caso, pero el ánodo aumenta su
corrosión, comparado con los metales aislados entre sí.
Este principio puede usarse como forma de protección de una estructura. La estructura
se usa como cátodo. Como ánodo se usa Zn o magnesio (Mg), que no son resistentes a
corrosión. El ánodo se sacrifica.
Corrosión localizada en aberturas
cantidades de solución estancada. Se deposita una sustancia (arena, polvo, corrosivo)
que actúa como escudo y crea las condiciones de ambiente estancado por debajo de
él. Se puede cortar el acero inoxidable colocándole una banda de goma alrededor y
sumergiéndolo en agua de mar. El efecto es formar una celda donde se concentra la
corrosión.
Corrosión tipo perforación (pitting)
Es una forma de corrosión localizada en grado extremo, que produce un agujero en el metal. Pueden hacer agujeros aislados o tan cercanos que dan la impresión visual de
una superficie rugosa.
Es una de las formas más destructivas, pero la perdida de material es muy poca. Es
difícil medirlo porque la perforación queda cubierta con el óxido. A veces requieren
tiempos largos para actuar (meses o años). Generalmente crece en la dirección de la
gravedad.
Corrosión intergranular
En la mayoría de los casos, los bordes entre granos no cumplen ningún rol especial, pero bajo ciertas condiciones, las interfases de granos son muy reactivas y se produce
corrosión localizada, sin que aparezca corrosión en los granos. Los granos se reparan, la aleación se desintegra o pierde rigidez. Puede ser causada por impureza en la aleación se desintegra o pierde rigidez. Puede ser causada por impureza en los
contornos de los granos. Es muy severa en soldaduras de acero inoxidable que ha sido
calentado 500 a 800C.
Corrosión por erosión
metal. En general este movimiento es bastante rápido y ocurren desgastes mecánicos
o abrasión. El proceso remueve metal de la superficie como iones disueltos o forma
productos sólidos de corrosión que son barridos mecánicamente de la superficie
metálica. Aparecen ranuras, ondulaciones, agujeros redondeados, pero con un patrón
direccional dado por el movimiento del fluido. Las fallas ocurren en tiempos cortos
(semanas) y son inesperadas porque los ensayos de laboratorios se hacen en
condiciones estáticas que no reflejan las condiciones de erosión del flujo.
Corrosión bajo tensión
por corrosión bajo tensión (SCC) el resto de la superficie no aparece afectada y
aparecen fisuras finas que van creciendo. Las tensiones necesarias para falla por SCC
son del orden de las de diseño. La apariencia de las fisuras es como si fuera fractura
frágil, pueden ser entre granos o ir por dentro de granos.
Para diferentes tipos de acero el comportamiento es similar: al aumentar σ disminuye
el tR. ¿Hay un σmin necesario para que exista un tR? Puede ser del orden del 10% σy.
La fuente de σ puede ser cargas externas, tensiones residuales, térmicas, de soldadura.
Inicialmente la tasa de progreso de una fisura es constante, hasta que la sección
transversal se reduce y aumenta σ, hasta que se produce la rotura como un proceso
mecánico.
El tiempo es importante en SCC, debido a que la mayor parte del daño mecánico
ocurre para tiempos avanzados.
Las deformaciones ε no aumentan significativamente durante el proceso de fisuración,
pero llega un tiempo de exposición al agente corrosivo en el que suben (similar a una
fisuración) y se rompe el material.
Esto muestra que los ensayos de SCC deben hacerse hasta la rotura, porque los
fenómenos importantes ocurren sólo en las etapas finales.
Los mecanismos de SCC no se conocen muy bien, debido a la complejidad del
acoplamiento del metal, la interfase y el ambiente. La información más confiable es la
empírica. La corrosión juega un papel muy importante en el inicio de una fisura. Esto
produce concentración de σ, que aumenta a medida que el radio del agujero o ranura
disminuye. Puede producirse deformación plástica en el extremo de fisuras. Corrosión con fatiga
Es otro caso de corrosión bajo σ, aunque ocurre cuando hay ciclos de σ en el tiempo.
Se observa en la zona de fatiga la aparición de productos de corrosión, en lugar de ser
una zona casi suave como en fatiga sola.
La fatiga con corrosión es la reducción de la resistencia a fatiga debido a la presencia
de un medio corrosivo. La presencia de óxido en la superficie no garantiza que la falla
sea debida a la fatiga con corrosión, puede ser fatiga simple.
Es importante en industria aeroespacial, nuclear, off-shore, submarinos.
Incide en la frecuencia de ciclos de σ, siendo más pronunciada cuando las frecuencias
son bajas, lo que da más tiempo a que actúe la corrosión, dando mayor tiempo de
contacto con el agente corrosivo.
Se cree que la resistencia a fatiga ase reduce por el agente corrosivo porque los
pequeños agujeros de corrosión producen concentración de tensiones. La falla trans –
granular (por dentro de granos) y no se muestran las ramificaciones que son
características de fisuras que progresan entre bordes de granos del material.
Las etapas finales de fatiga con corrosión son iguales a las de fatiga porque ese
proceso es mecánico y no incide el agente corrosivo.
En la mecánica de fractura se suele cambiar KIC por otro valor KIC
SCC
que tome en
cuenta que la corrosión reduce la resistencia del material.
Por debajo de KIC
SCC
no ocurre fisuración por corrosión y deja de importar. Este
enfoque también se usa en fatiga con corrosión. Funciona bien en aceros con
aleaciones bajas y de alta resistencia. Es menos efectivo en aceros inoxidables
auteríticos.
CORROSION ATMOSFERICA
U
NO de los factores que determina primariamente la intensidad del fenómeno corrosivo en la atmósfera es la composición química de la misma. El S02 y el NaCl son los agentes corrosivos más comunes de la atmósfera. El NaCl se incorpora a la atmósfera desde el mar. Lejos de éste, la contaminación atmosférica depende de la presencia de industrias y núcleos de población, siendo el contaminante principal por su frecuencia de incidencia sobre el proceso corrosivo el dióxido de azufre (S02), proveniente del empleo de combustibles sólidos y líquidos que contienen azufre.El mecanismo de corrosión es de naturaleza electroquímica. El electrolito es una capa de humedad sobre la superficie del metal cuyo espesor varía desde capas muy delgadas (invisibles) hasta capas que mojan perceptiblemente el metal. La duración del proceso de corrosión depende sobre todo del tiempo durante el cual la capa de humedad permanece sobre la superficie metálica.
Como el mecanismo de corrosión es electroquímico, su característica principal es la presencia de un proceso anódico y otro catódico, con un electrólito de resistencia óhmica determinada.
En el proceso anódico el metal se disuelve en la capa del electrolito, en la cual la concentración se eleva hasta la precipitación de un compuesto poco soluble.
En el proceso catódico, bajo la capa de humedad, la mayoría de los metales expuestos a la atmósfera se corroen por el proceso de reducción de oxígeno.
La resistencia óhmica entre las zonas anódica y catódica de las minúsculas pilas de corrosión que se distribuyen sobre el metal es grande cuando el espesor de la capa de humedad es pequeño.
a) Corrosión seca. Se produce en los metales que tienen una energía libre de formación de óxidos negativa.
b) Corrosión húmeda. Requiere de la humedad atmosférica, y aumenta cuando la humedad excede de un valor crítico, frecuentemente por encima del 70%.
c) Corrosión por mojado. Se origina cuando se expone el metal a la lluvia o a otras fuentes de agua.
La acción conjunta de los factores de contaminación y los meteorológicos determinan la intensidad y naturaleza de los procesos corrosivos, y cuando actúan simultáneamente, aumentan sus efectos. También es importante mencionar otros factores como las condiciones de exposición, la composición del metal y las propiedades del óxido formado, que combinados entre sí influyen en los procesos de corrosión.
La característica atmosférica más importante que se relaciona directamente con el proceso de corrosión es la humedad, que es el origen del electrolito necesario en el proceso electroquímico.
La figura III.1 muestra la relación que existe entre la corrosión atmosférica y el espesor de la capa del electrolito sobre la superficie metálica. Se observa que en espesores pequeños la corrosión no existe, pues la resistencia óhmica de la capa del electrolito sobre la superficie metálica es muy grande y la disolución del metal es difícil. Al aumentar el espesor disminuyen la resistencia de la capa del electrolito y la polarización catódica, lo que origina un aumento en la velocidad de corrosión hasta que alcanza un nivel máximo, que disminuye después con el aumento del espesor. En esta zona, la reacción catódica es determinante en el proceso de corrosión; el factor óhmico y la polarización anódica pierden importancia, pues la difusión de oxígeno en la superficie metálica es muy lenta y por tanto determinante del proceso global.
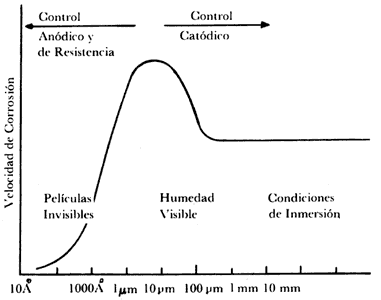
Figura III.1. Influencia del espesor de la película de humedad condensada sobre la superficie metálica en la velocidad de corrosión.
Esto nos permite comprobar la importancia del conocimiento de las causas y los factores que influyen en la formación de películas de humedad sobre la superficie metálica. La causa más importante es la precipitación atmosférica (en forma de lluvia o niebla espesa).
Existe también la condensación de humedad, que se origina cuando la humedad relativa de la atmósfera sobrepasa el 100%. Es importante mencionar también la condensación por adsorción, la condensación capilar y la condensación química.
Cuando se alcanza el nivel de humedad necesario para la formación de pilas de corrosión, comienza a ser importante un segundo factor: de contaminación atmosférica.
PRINCIPALES AGENTES CONTAMINANTES PARA LA CORROSION ATMOSFERICA
-Atmosférica
Oxidación Corrosión, Radiación solar, Corrosión marina
-Biológica Corrosión Microbiologíca
-Mecánica Corrosión bajo tensión y relacionadas con fuerzas externas
FORMAS DE EVITAR LA CORROSION
Hay tres métodos para evitar la oxidación del hierro :
Mediante aleaciones del hierro que lo convierten en químicamente resistente a la corrosión
impregnándolo con materiales que reaccionen a las sustancias corrosivas más fácilmente que el hierro, quedando éste protegido al consumirse aquéllas
Recubriéndolo con una capa impermeable que impida el contacto con el aire y el agua.
El método de la aleación es el más satisfactorio pero también el más caro. Un buen ejemplo de ello es el acero inoxidable, una aleación de hierro con cromo o con níquel y cromo. Esta aleación está totalmente a prueba de oxidación e incluso resiste la acción de productos químicos corrosivos como el ácido nítrico concentrado y caliente.
El segundo método, la protección con metales activos, es igualmente satisfactorio pero también costoso. El ejemplo más frecuente es el hierro galvanizado que consiste en hierro cubierto con cinc. En presencia de soluciones corrosivas se establece un potencial eléctrico entre el hierro y el cinc, que disuelve éste y protege al hierro mientras dure el cinc.
El tercer método, la protección de la superficie con una capa impermeable, es el más barato y por ello el más común.
Este método es válido mientras no aparezcan grietas en la capa exterior, en cuyo caso la oxidación se produce como si no existiera dicha capa. Si la capa protectora es un metal inactivo, como el cromo o el estaño, se establece un potencial eléctrico que protege la capa, pero que provoca la oxidación acelerada del hierro.
Los recubrimientos más apreciados son los esmaltes horneados, y los menos costosos son las pinturas de minio de plomo. Algunos metales como el aluminio, aunque son muy activos químicamente, no suelen sufrir corrosión en condiciones atmosféricas normales.
Generalmente el aluminio se corroe con facilidad, formando en la superficie del metal una fina capa continua y transparente que lo protege de una corrosión acelerada.
El plomo y el cinc, aunque son menos activos que el aluminio, están protegidos por una película semejante de óxido.
El cobre, comparativamente inactivo, se corroe lentamente con el agua y el aire en presencia de ácidos débiles como la disolución de dióxido de carbono en agua —que posee propiedades ácidas—, produciendo carbonato de cobre básico, verde y poroso.
Los productos de corrosión verdes, conocidos como cardenillo o pátina, aparecen en aleaciones de cobre como el bronce y el latón, o en el cobre puro, y se aprecian con frecuencia en estatuas y techos ornamentales.
Los metales llamados nobles son tan inactivos químicamente que no sufren corrosión atmosférica. Entre ellos se encuentran los antes indicados, el oro, la plata y el platino.
La combinación de agua, aire y sulfuro de hidrógeno afecta a la plata, pero la cantidad de sulfuro de hidrógeno normalmente presente en la atmósfera es tan escasa que el grado de corrosión es insignificante, apareciendo únicamente un ennegrecimiento causado por la formación de sulfuro de plata. Este fenómeno puede apreciarse en las joyas antiguas y en las cuberterías de plata.
La corrosión en los metales supone un problema mayor que en otros materiales. El vidrio se corroe con soluciones altamente alcalinas, y el hormigón con aguas ricas en sulfatos. La resistencia a la corrosión del vidrio y del hormigón puede incrementarse mediante cambios en su composición, ó técnicas adecuadas.
No hay comentarios:
Publicar un comentario